ในกลศาสตร์ทั่วไป(Classical Mechanics) ได้อธิบายเกี่ยวกับอะตอมไว้ว่า อะตอมจะมีนิวเคลียสอยู่ตรงกลางและมีอิเล็กตรอนวิ่งวนอยู่รอบ ๆ ซึ่งนิวเคลียสจะประกอบไปด้วย โปรตอนที่มีประจุบวกและนิวตรอนที่เป็นกลางทางไฟฟ้า
แบบจำลองอะตอมจาก Classical Mechanics
ภาพจาก http://www.wpclipart.com/science/atoms_molecules/atom_diagram.png.html
ระดับพลังงานของอะตอมส่วนใหญ่กล่าวถึงที่ระดับพลังงานของอิเล็กตรอน ซึ่งระดับพลังงานจะมีพลังงานเฉพาะค่า ซึ่งอะตอมจะดูดกลืนและคายพลังงานเมื่ออิเล็กตรอนมีการเปลี่ยนระดับชั้นพลังงาน
อิเล็กตรอนสามารถเปลี่ยนระดับชั้นพลังงานได้ เมื่อได้รับโฟตอนที่มีความถี่สอดคล้องกับพลังงาน ซึ่งมีค่าเท่ากับผลต่างของระดับพลังงานสถานะเริ่มต้น(initial state) และสถานะสุดท้าย(final state)
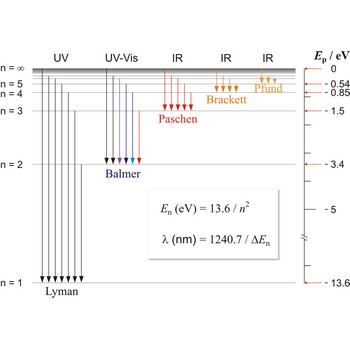
ภาพแสดงระดับชั้นพลังงานของอิเล็กตรอนของไฮโดรเจน
ภาพจาก astro.unl.edu/naap/hydrogen/transitions.html
ณ ที่ระดับพลังงานต่ำสุดมักจะให้ระดับพลังงานของอิเล็กตรอนมีค่าติดลบและฟรีอิเล็กตรอน(free electron) มีค่าเป็นบวก เมื่ออิเล็กตรอนได้รับพลังงานที่สูงกว่า

จะทำให้อิเล็กตรอนกลายเป็นไอออน(ion) เรียกว่า ionization นักดาราศาสตร์ฟิสิกส์มักจะเรียกว่า bound-free transition ซึ่งแตกต่างจากการถูกกระตุ้น เพราะพลังงานมีค่ามากกว่าศูนย์ ทำให้หลุดออกสู่สภาวะภายนอก พลังงานที่มันดูซับจะเปลี่ยนไปอยู่ในรูปพลังงานจลน์(kinetic energy) ในทางกลับกันเมื่ออะตอมจับกับอิเล็กตรอนอิสระ(free electron) จะเรียกว่า recombination หรือ free-bound transition
ทำไมถึงต้องให้ระดับพลังงานของอิเล็กตรอนมีค่าติดลบ ??
เหตุผลก็คือ เมื่อเราพิจารณาพลังงานศักย์โน้มถ่วงของอิเล็กตรอนที่วิ่งอยู่รอบนิวเคลียส เมื่ออิเล็กตรอนเคลื่อนที่ออกจากนิวเคลียส แน่นอนพลังงานศักย์โน้มถ่วงก็ต้องเพิ่มมากขึ้น(เหตุการณ์คล้ายกับเราเคลื่อนที่ออกนอกโลก) ส่วนพลังงานศักย์ไฟฟ้าก็ต้องมีค่าน้อยลงตามระยะทาง
ดังนั้น เมื่อเราลองจินตนาการเมื่ออะตอมเคลื่อนที่ออกห่างจากนิวเคลียสเป็นระยะทางอนันต์(Infinity) พลังงานศักย์โน้มถ่วงก็ต้องมีค่าอนันต์และพลังงานศักย์ไฟฟ้าก็ต้องมีค่าเท่ากับศูนย์ Ohhh!!! นั่นก็หมายความว่า ที่ระดับพลังงานสูงสุดพลังงานศักย์ของอิเล็กตรอนมีค่าเท่ากับศูนย์ เพราะฉะนั้นค่าพลังงานของอิเล็กตรอนจึงมีค่าติดลบ
ในแต่ละอะตอมมีโครงสร้างอิเล็กตรอนที่แตกต่างกัน ธาตุแต่ละธาตุสามารถระบุได้โดยโฟตอนที่มันดูดซับหรือปล่อยออกมาจากอิเล็กตรอนที่เคลื่อนที่จากระดับพลังงานจากชั้นหนึ่งไปอีกชั้นหนึ่ง
สำหรับอะตอมเดี่ยวจะให้ผลที่ชัดเจนเมื่อเราตรวจสอบสเปกตรัมของธาตุที่แตกต่างกัน เป็นเพราะเมื่อพวกมันมีพันธะกับอะตอมอื่น ๆ อิเล็กตรอนจะได้รับอิทธิพลจากภายนอกมากกว่าจากตัวของมันเอง ซึ่งทำให้ผลของเราคลาดเคลื่อน ดังนั้นเพื่อให้ได้ผลที่ดีเราจะใช้ก๊าซที่มีความดันต่ำในท่อไอน้ำ
The absorption spectrum
แสงขาวเมื่อส่องผ่านไอของก๊าซความดันต่ำ แล้วนำเส้นสเปกตรัมมาวิเคราะห์จะเห็นช่องว่างของแถบสเปกตรัม เรียกว่า absorption spectrum
The emission spectrum
เมื่อเรากระตุ้นอิเล็กตรอนในไอ (โดยใช้โฟตอนหรืออิเล็กตรอนก็ได้) อิเล็กตรอนในไอจะเก็บพลังงานแล้วคายออกมาเมื่อมันลดพลังงานจากระดับที่สูงกว่าลงสู่ระดับที่ต่ำกว่า ซึ่งจะให้แถบสีต่าง ๆ ที่บอกถึงความถี่ของแสงที่อิเล็กตรอนคายเมื่อมันลดระดับพลังงาน เรียกว่า emission spectrum
ภาพจาก http://lcogt.net/book/spectroscopy
ทำไมต้องใช้ก๊าซความดันต่ำ ??
ในก๊าซที่มีความดันสูง จะมีความหนาแน่นสูงตามไปด้วย เมื่ออิเล็กตรอนถูกกระตุ้นไปที่สถานะถูกกระตุ้น(excited state) พวกมันจะไม่มีเวลาพอที่จะลดพลังงานตัวเองไปที่สถานะพื้น(ground state) เนื่องจากอะตอมจะชนกับอะตอมข้างเคียงก่อน ด้วยเหตุนี้จะทำให้แถบสเปกตรัมเลือนลางไม่ชัดเจน โดยทั่วไปแล้วอะตอมจะมีช่วงเวลาเมื่ออยู่ที่ excited state ประมาณ 10 ns
ดังนั้นการใช้ก๊าซความดันต่ำจะทำให้สามารถเห็นเส้นสเปกตรัมที่ชัดเจน
 = มวลอิเล็กตรอน
= มวลอิเล็กตรอน ซึ่งเท่ากับผลต่างของระดับชั้นพลังงาน
ซึ่งเท่ากับผลต่างของระดับชั้นพลังงาน = สภาพยอม
= สภาพยอม

 คือ
คือ เป็นค่าคงที่ ที่ ground state (n=1) จาก (5) จะได้
เป็นค่าคงที่ ที่ ground state (n=1) จาก (5) จะได้ คือ ค่าคงที่ริดเบอร์ก =
คือ ค่าคงที่ริดเบอร์ก = 
 ว่า Balmer series ซึ่งอยู่ในช่วง visible spectrum และถ้าอิเล็กตรอนกลับมาที่ ground state
ว่า Balmer series ซึ่งอยู่ในช่วง visible spectrum และถ้าอิเล็กตรอนกลับมาที่ ground state  เรียกว่า Lyman series ซึ่งอยู่ในช่วง ultraviolet และยังมี series อื่น ๆ อีกมากมาย
เรียกว่า Lyman series ซึ่งอยู่ในช่วง ultraviolet และยังมี series อื่น ๆ อีกมากมาย